Veränderungen in der Form der Sprossspitze sind mit dem Übergang zur Blüte bei Arabidopsis synchronisiert
Wenn Pflanzen die Blüte einleiten, vergrößert sich die Sprossspitze und wird genetisch umprogrammiert. Wie diese Veränderungen in der Form der Sprossspitze jedoch mit dem Übergang zur Blüte zusammenhängen, ist unbekannt. In einer neuen Studie, die in Nature Communications veröffentlicht wurde, zeigen Forscher aus der Gruppe von George Coupland am Max-Planck-Institut für Pflanzenzüchtungsforschung in Köln, dass die wechselseitige Unterdrückung von zwei Genen an der Pflanzenspitze die Veränderungen der Meristemform mit dem Blütenübergang bei der Modellpflanze Arabidopsis thaliana synchronisiert.
Die Pflanzen der Ackerschmalwand (Arabidopsis thaliana) gehen vom vegetativen Wachstum zur Blüte über, wenn sie den langen Frühlings- und Sommertagen ausgesetzt sind. Als Reaktion auf diese Umwelteinflüsse wird das Gewebe an der Spitze der Pflanze, das so genannte Sprossapikalmeristem (SAM), genetisch umprogrammiert, so dass es anstelle von Blättern Blüten bildet. Gleichzeitig vergrößert und verlängert sich das SAM, so dass es eine charakteristische gewölbte Form annimmt. Da nicht bekannt ist, wie sich die Form des SAM während des Übergangs zur Blüte verändert, haben die Autorinnen und Autoren zunächst im Detail untersucht, wie sich die innere Organisation des SAM während des Übergangs zur Blüte verändert. Das SAM enthält zwei große Unterdomänen, und seine Größe wird durch Wechselwirkungen zwischen Proteinen reguliert, die in diesen Regionen charakteristisch exprimiert werden. Die Autorinnen und Autoren verwendeten zwei fluoreszierende Reportermarker, die für diese beiden Domänen spezifisch sind, und zeichneten ihre Expression im Zeitverlauf auf, als die Pflanzen zu blühen begannen. Eine Computerpipeline, die die Intensität dieser fluoreszierenden Proteine in Zellgruppen relativ zur Triebspitze quantifizierte zeigte genau, wie die Zunahme der Gesamtbreite und -höhe des SAM während des Blütenübergangs mit den Veränderungen in der Größe der internen Domänen korrelierte. Sie fanden heraus, dass insbesondere die zentrale Zone an der Spitze des SAM an Höhe und Breite zunahm und dass die periphere Zone an den Flanken des SAM während des Blütenübergangs deutlich an Breite gewann.
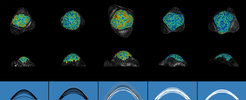
Die Autorinnen und Autoren konzentrierten sich dann auf das AP2-Gen, das für einen Transkriptionsregulator kodiert, der die Wölbung des SAM fördert, aber auch die Blüte unterdrückt. Die Menge des AP2-Proteins im SAM ist vor der Blüte hoch und wird nach und nach abgebaut. Wenn die Zeit, in der AP2 vorhanden ist, verlängert wird, nimmt die Breite des SAM zu. Um herauszufinden, wie AP2 die Veränderungen der SAM-Morphologie während des Blütenübergangs reguliert, verglichen die Autorinnen und Autoren die Gene, die in SAMs exprimiert werden, die entweder AP2 exprimieren oder denen AP2 fehlt und verglichen die daraus resultierenden unterschiedlich exprimierten Gene mit denjenigen, von denen bekannt ist, dass sie direkt von AP2 reguliert werden. Mit diesem Ansatz identifizierten sie das SOC1-Gen, das für eine andere Klasse von Transkriptionsregulatoren kodiert, und charakterisierten sein Muster der Proteinexpression im SAM im Vergleich zu dem von AP2 während des Übergangs zur Blüte. Die Proteine zeigen während des Übergangs zur Blüte entgegengesetzte Anreicherungsmuster, wobei AP2 allmählich verschwindet, während SOC1 sich allmählich anreichert, was damit übereinstimmt, dass die Blüte durch AP2 unterdrückt und durch SOC1 gefördert wird. Außerdem haben Mutanten, denen SOC1 fehlt, ein großes SAM, und SOC1 reichert sich in den SAMs von Pflanzen, denen AP2 fehlt, stärker an, was darauf hindeutet, dass AP2 die SOC1-Produktion unterdrückt. Diese Beobachtungen in Verbindung mit der Fähigkeit beider Proteine, direkt an die Gene des jeweils anderen zu binden, lassen vermuten, dass die gegenseitige Unterdrückung von AP2 und SOC1 im SAM eine Rolle bei der Verknüpfung von Veränderungen der SAM-Größe und der Blütenproduktion spielt.
Ein Modell der gegenseitigen Rückkopplung erklärt, wie SAM-Morphologie und Blüte zusammenhängen
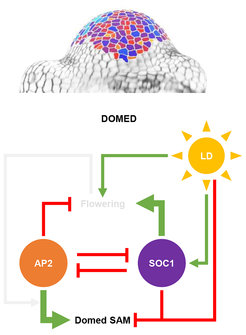
Die Autorinnen und Autoren kombinierten ihre Beobachtungen in einem Modell, das genau erklärt, wie AP2 und SOC1 die Veränderungen der SAM-Morphologie mit dem Blühzeitpunkt und der Blütenproduktion synchronisieren. Während der vegetativen Entwicklung verzögert AP2 den Übergang zur Blüte, zum Teil durch Unterdrückung des SOC1-Gens , hat aber keinen Einfluss auf die SAM-Morphologie. Wenn die Pflanzen durch lange Tage zur Blüte angeregt werden, steigt die Menge von SOC1 an, was wiederum die Produktion von AP2 unterdrückt und die Blüte fördert. Bevor AP2 vollständig verschwindet, fördert es die Zunahme der SAM-Höhe und -Breite, und sein Verschwinden sorgt dafür, dass das SAM nicht übermäßig in die Breite wächst. Ein zentrales Merkmal des Modells ist die Bedeutung der gegenseitigen Unterdrückung von AP2 und SOC1, die das Zeitintervall bestimmt, in dem beide Faktoren exprimiert werden. Dies bestimmt den Zeitpunkt der Blütenproduktion und begrenzt das Stadium, in dem AP2 Veränderungen der SAM-Morphologie fördert. Diese Art der direkten wechselseitigen Unterdrückung wurde bei Entwicklungsprozessen in Tieren charakterisiert, und die Studie trägt dazu bei, zu unterstreichen, wie Entwicklungsentscheidungen in Pflanzen durch Umweltsignale ausgelöst werden, die genregulatorische Netzwerke induzieren, die in robusten räumlich-zeitlichen Mustern zum Ausdruck kommen.













