Meristem-spezifische Expression epigenetischer Regulatoren gewährleistet die Inaktivierung von Transposons in Arabidopsis thaliana
Forschungsbericht (importiert) 2013 - MPI für Pflanzenzüchtungsforschung
Transposons: springende DNA-Abschnitte
Das Genom höherer, mehrzelliger Organismen besteht zu einem großen Teil aus potenziell mobilen, transponierbaren DNA Elementen, den sogenannten Transposons. Aktive Transposons können sich vervielfältigen und mehr oder weniger zufällig wieder in die DNA eingebaut werden. Da sie auch in Protein-kodierende Gene oder deren regulatorische Sequenzen springen und damit deren Aktivität beeinflussen können, stellen sie eine Gefahr für den Organismus dar. Dies ist insbesondere der Fall, wenn die Verschiebung von Transposons in den Zellen der Keimbahn auftritt, aus denen sich die Nachkommen bilden.
Im Laufe der Evolution haben Pflanzen verschiedene Mechanismen entwickelt, die eine übermäßige Mobilisierung dieser Elemente verhindern. Diese Mechanismen basieren auf Modifikationen des Chromatins, wie DNA-Methylierung und bestimmte Modifikationen der Histone, und können die Transkription der Transposons und damit deren Bewegung unterdrücken. Solche Modifikationen werden auch als epigenetische Modifikationen bezeichnet, da sie die Expression von DNA-Sequenzen regulieren können, ohne die genetische Information, also die Sequenz selbst, zu verändern [1]. Einer dieser Mechanismen, die RNA-abhängige DNA-Methylierung, wird durch die Transkripte der Transposons aktiviert und führt zur Methylierung der Cytosinbasen in den komplementären, genomischen DNA Sequenzen. Weitere, teilweise redundante Mechanismen, sind für die Erhaltung und korrekte Vererbung der etablierten Methylierungsmuster verantwortlich. Die koordinierte Aktivität dieser Mechanismen schließlich führt zur Immobilisierung der Transposons - eine Störung dieser Mechanismen kann folglich wieder zur Aktivierung von Transposons führen.
Bei Säugetieren kommt es mit der Ausbildung der Keimbahn sehr früh zur Entwicklung der Keimzellen. Im Gegensatz dazu werden Keimzellen in Pflanzen erst spät, nämlich in der generativen Entwicklungsphase durch das Sprossapikalmeristem(SAM) gebildet. Zuvor durchlaufen diese Meristeme eine Vielzahl von vegetativen Zellteilungen. Ein weiterer Unterschied zwischen Säugern und Pflanzen besteht in der Beständigkeit der DNA-Methylierung in den Keimzellen. Während bei Säugern die DNA-Methylierung in den Zellen der Keimbahn zunächst größtenteils entfernt und erst während der Reifung der Keimzellen und der Bildung der Zygote wieder etabliert wird, ist die DNA-Methylierung in Pflanzen vergleichsweise stabil. Es konnte gezeigt werden, dass die Immobilisierung von Transposons in den Gameten und in frühen Embryonalstadien durch mobile kleine RNAs (small interfering RNAs, siRNAs) unterstützt wird. Daher wird angenommen, dass die RNA-abhängige DNA-Methylierung in Pflanzen eine wichtige Rolle bei der Kontrolle des Genoms von Gameten und Zygote spielt [2, 3].
Experimente zeigten, dass es in Arabidopsis thaliana Pflanzen, die auf einem Zebularin haltigen Nährmedium angezogen wurden, zur Reaktivierung einiger inaktiver Transposons kommt [4]. Zebularin ist eine Verbindung, die dem Nukleosid Cytidin sehr ähnlich ist und wie diese während der Replikation in die DNA eingebaut werden kann. Der Einbau von Zebularin führt zu einer Verringerung der DNA-Methylierung - die sich daraus ergebende Hypomethylierung der DNA ist für die beobachtete Reaktivierung bestimmter Transposons verantwortlich. Interessanterweise aber sind sowohl die Hypomethylierung als auch die Reaktivierung der Transposons nicht dauerhaft [4]. Dies deutet auf einen Mechanismus hin, der der Zebularin induzierten Hypomethylierung und Reaktivierung entgegenwirkt. Dieser Mechanismus ist bisher unbekannt und von besonderem wissenschaftlichem Interesse.
Inaktive Reportergene werden durch Zebularin aktiviert
Ein beliebter Ansatz, um regulatorische Mechanismen zu untersuchen, ist die Analyse von Pflanzen, in die fremde DNA Sequenzen, sogenannte Transgene, eingebracht wurden. Sie enthalten meist sogenannte Reportergene, die bei ihrer Expression, das heißt bei der Bildung des kodierten Proteins, zu einer Veränderung des Phänotyps, das heißt dem Aussehen der Pflanze, führen. Zum Missfallen vieler Wissenschaftler wird die Transkription und damit die Expression der Reportergene jedoch häufig durch die gleichen Prozesse unterdrückt, die für die Inaktivierung von Transposons verantwortlich sind [5]. Anhand dieser ungewollt stillgelegten Transgene lassen sich die molekularen Mechanismen, die für eine Inaktivierung von Transposons verantwortlich sind, sehr gut untersuchen. Besonders diejenigen transgenen Pflanzen sind interessant, in denen eine Störung des Inaktivierungsmechanismus vorliegt - sie wird durch die Expression des sonst stillgelegten Reportergens und damit durch die Veränderung des Phänotyps der Pflanze sichtbar.
Zur Aufklärung der molekularen Grundlagen der vorübergehenden Transposon-Aktivierung wurde zunächst die Expression zweier transkriptionell inaktivierter Reporter-Transgene in A. thaliana Pflanzen untersucht. Nach deren Anzucht auf zebularinhaltigem Medium konnte eine gewebsspezifische Reaktivierung der Reportergene beobachtet werden - aber nur in den Keimblättern. Weder in den Blättern der Blattrosette noch in den Blüten war eine Zunahme der Reportergenaktivität nachweisbar. Sogar in den Nachkommen zebularinexprimierter, selbstbefruchteter Pflanzen wurde keine Reaktivierung der Reportergene beobachtet. Da es sich bei Transgenen um künstlich in die Pflanzen gebrachte DNA-Sequenzen handelt, sind die mit den Reporter-Transgenen gewonnenen Erkenntnisse nur beschränkt aussagekräftig. Die Beobachtungen könnten beispielsweise nur für diese Transgene zutreffen, jedoch nicht für die endogenen, das heißt pflanzeneigenen, repetitiven Transposon-Sequenzen. Um dies auszuschließen wurde auch die Transkriptmenge mehrerer Transposons mittels quantitativer PCR bestimmt. Wie im Falle des Reportergens, konnte nur in den Keimblättern von zebularinexprimierten Pflanzen eine Zunahme der Transposontranskripte festgestellt werden (Abb. 1).
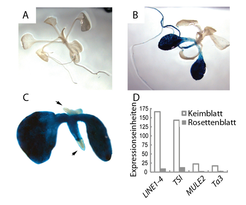
Die normalen, „echten“ Blätter einer Pflanze unterscheiden sich in einem Punkt grundlegend von ihren Keimblättern. Während die echten Blätter erst nach der Keimung des Samens ausgebildet werden, sind die Keimblätter Teil des Embryos und bereits vor der Samenkeimung vorhanden. Die beobachtete, gewebespezifische Reaktivierung reprimierter Sequenzen in embryonalem Keimblattgewebe nach Gabe von Zebularin deutet auf einen Mechanismus hin, der den Verlust der transkriptionellen Inaktivierung nach der Samenkeimung kompensiert.
Reportergene und Transposons sind in Rosettenblättern von Mutanten aktiv
Um die molekularen Grundlagen der gewebespezifischen Unterschiede bei der Aktivierung der reprimierten Sequenzen besser zu verstehen, wurde die Aktivität eines der Reporter-Transgene in einer Vielzahl von Mutanten analysiert, in denen die Transposon-Inaktivierung und bzw. oder die Chromatinstruktur verändert ist. Pflanzen, die sowohl für das Reporter- Transgen als auch für die jeweilige Mutation homozygot waren, wurden auf zebularinfreiem Medium angezogen und in den verschiedenen Geweben wurde die Aktivität des Reportergens bestimmt.
In Übereinstimmung mit zuvor veröffentlichten Ergebnissen konnte eine vollständige Reaktivierung des Reportergens nur in Pflanzen beobachtet werden, in denen die Gene MET1 oder DDM1, die vor allem für die Erhaltung der DNA-Methylierung eine Rolle spielen, mutiert waren. In allen anderen getesteten Mutanten konnte nur eine schwache, keimblattspezifische Reportergen-Reaktivierung festgestellt werden. Letztere glichen damit den zebularinexponierten Pflanzen (Abb. 1).
Um mögliche kombinatorische Effekte der Zebularinexposition und den jeweiligen Mutationen zu untersuchen, wurden diejenigen Mutanten, die eine schwache Reportergenaktivität aufwiesen, auf zebularinhaltigem Medium angezogen. Dabei konnte in Mutanten, in denen die RNA-abhängige DNA-Methylierung beeinträchtigt war, neben der zuvor beobachteten Reportergen-Aktivität in den Keimblättern interessanterweise auch eine starke Reaktivierung des Reportergens in den Rosettenblättern beobachtet werden. Auch die analysierten Transposon-Sequenzen wiesen in diesen Pflanzen nun eine erhöhte Aktivität in den Rosettenblättern auf (Abb. 2).

Diese interessanten Ergebnisse lassen vermuten, dass der Mechanismus der RNA-abhängigen DNA-Methylierung der zebularininduzierten Störung der DNA-Methylierung entgegenwirkt. Um diese Überlegung zu untermauern, wurden Mutanten und Vergleichspflanzen nach Anzucht auf zebularinfreiem Medium auf zebularinhaltiges Medium umgesetzt, und wiederum wurde die Reportergen-Aktivität bestimmt. Dabei konnte nur in denjenen Pflanzengeweben Reportergenaktivität nachgewiesen werden, die sich während der Zebularinexposition entwickelt haben. Diese Beobachtung lässt sich anhand der Tatsache erklären, dass der Einbau von Zebularin in die DNA nur während der DNA-Replikation erfolgt. Die Abwesenheit von Replikationsaktivität in den bereits bestehenden Geweben schützt folglich vor dem Einbau von Zebularin in die DNA und, damit verbunden, vor der Hypomethylierung und folglich auch vor einer Reaktivierung von Transposons. Diese Ergebnisse zeigen, dass die RNA-abhängige DNA-Methylierung tatsächlich der Störung durch Zebularin entgegenwirkt und eine zentrale Rolle bei einer erneuten Inaktivierung transponierbarer Elemente in vegetativen Geweben spielt.
Einmal aktivierte Sequenzen sind auch in der folgenden Generation aktiv
Eine weitere interessante Frage war, ob die beobachtete Reaktivierung auch nach Entfernung des Zebularins aus dem Medium weiter anhält. Dazu wurde zunächst getestet, ob die Aktivität des Reportergens und der Transposons auch in Geweben nachweisbar war, die sich erst mehrere Wochen nach der Zebularinexposition gebildet haben. Auffallenderweise konnte in einigen Mutanten eine Aktivität in den voll ausgebildeten Blättern nachgewiesen werden. Diese beschränkte sich jedoch in den meisten Fällen auf wenige Stellen auf den Blättern, die sich zudem in Größe, Form und Position zwischen verschiedenen Pflanzen der gleichen Mutante sehr stark unterschieden. Diese Beobachtungen wiederum warfen die Frage auf, ob die Reaktivierung auch auf die nächste Pflanzengeneration übertragen werden kann. Entsprechend wurde die Reportergen-Aktivität in den Nachkommen von zebularinexprimierten Vergleichs- und Mutantenpflanzen bestimmt und mit der Aktivität in Nachkommen von Pflanzen, die nicht der Chemikalie ausgesetzt gewesen waren, verglichen. Es stellte sich heraus, dass die Reportergen-Aktivität in den Nachkommen der zebularinexponierten Mutanten sich nicht nur auf die Keimblätter beschränkte, sondern auch in den jungen Rosettenblättern eindeutig nachzuweisen war. Dieses Ergebnis zeigt, dass die Aktivierung tatsächlich auf die nächste Generation übertragen werden kann. Darüber hinaus untermauert die eingeschränkte Stilllegung der Reportergene und Transposons in denjenigen Mutanten, in denen die RNA-abhängige DNA-Methylierung unterbrochen ist, dass dieser Mechanismus eine Art Schutzfunktion für die Pflanze beherbergt.
Aktivität der Gene im Sprossapikalmeristem
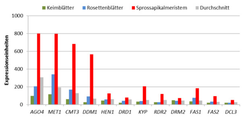
In den hier vorgestellten Untersuchungen war festgestellt worden, dass in den teilungsaktiven Pflanzengeweben der Sprossachse, also dem Spross-Apikalmeristem (SAM), die Expression der Reportergene nicht durch Zebularin induziert werden konnte - in den sich daraus entwickelnden echten Blättern trat keine Blaufärbung auf (Abb. 1). Das lässt darauf schließen, dass das SAM eine entscheidende Rolle bei der Vermittlung der gewebespezifischen Reaktion spielt. Um dieser Vermutung nachzugehen, wurde die Genexpression im SAM mit der von 49 anderen Geweben mit Hilfe einer Datenbank verglichen. Der Vergleich von 16 Genen, von denen bekannt ist, dass sie an der Inaktivierung von Transposons beteiligt sind, zeigte, dass diese Gene am stärksten im SAM exprimiert werden (Abb. 3). Außerdem wurde festgestellt, dass auch viele andere Gene, die an der Veränderung des Chromatins beteiligt sind, in diesem Gewebe sehr stark ausgeprägt werden. Neben dem SAM weisen auch andere Meristeme gleiche Charakteristika auf.
Fasst man alle diese Ergebnisse zusammen, kann gefolgert werden, dass die erhöhte Expression der Komponenten des Mechanismus der RNA-abhängigen DNA-Methylierung sowie anderer Chromatin assoziierter Proteine in den Meristemen eine Art Schutzvorrichtung darstellt - diese gewährleistet die korrekte Weitergabe der Transposon-Inaktivierung an sich neu entwickelnde Gewebe und Organe sowie an die sich später entwickelnden Keimzellen (Abb. 4).
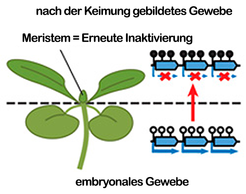
Die Genomforschung ist damit einem weiteren spannenden Mechanismus auf die Spur gekommen, der nicht nur die Kontrolle von Transposons besser verständlich macht, sondern auch epigenetische Effekte beschreibt, die untermauern, dass die Vererbung von neuen Merkmalen an die nächste Generation nicht nur durch unumkehrbare Veränderungen der DNA-Sequenz erfolgen kann, sondern auch durch umkehrbare chemische Modifikationen am DNA-Molekül selbst. Wie die hier dargestellten Untersuchungen an Mutanten zeigen, werden diese Modifikationen wiederum durch spezielle Gene kontrolliert.



