Proteinmodifikatoren als Regulatoren pflanzlicher Entwicklung
Forschungsbericht (importiert) 2004 - MPI für Pflanzenzüchtungsforschung
Proteine als Katalysatoren biologischer Prozesse werden auch nach ihrer Synthese noch verändert. Neben ungewollten Prozessen wie zum Beispiel Oxidation, die ihre Lebensdauer beeinträchtigen, gibt es eine Reihe so genannter posttranslationaler Modifikationen. Diese können den Zustand eines Proteins verändern und dadurch biologische Vorgänge beeinflussen. Schon seit langem ist bekannt, dass Phosphat- oder Essigsäurereste an Proteine angeheftet und wieder abgespalten werden können. In den letzten Jahren zeigte sich, dass in höheren Organismen auch kleinere Proteine als Modifikatoren verwendet werden. Zurzeit ist noch nicht abzusehen, wie viele verschiedene Modifikatorproteine es eigentlich gibt. Abbildung 1 zeigt den Vergleich der Aminosäurefolge für einige Modifikatoren aus verschiedenen Organismen im zweidimensionalen Diagramm, wobei die Punkte einzelne Proteine repräsentieren. Der Abstand zwischen Punkten ist ein Maß für die Ähnlichkeit, welche durch paarweise Sequenzvergleiche ermittelt wurde. Das bekannteste Modifikatorprotein, Ubiquitin, ist eines der am stärksten konservierten Proteine, das heißt, die Homologen aus verschiedenen Organismen unterscheiden sich kaum. Andere Modifikatoren, wie SUMO, zeigen mehr Variabilität, können aber im Vergleich verschiedener Arten trotzdem eindeutig als Homologe erkannt werden.

Die Modifikatoren werden meist als Vorstufen hergestellt. Spezifische Spaltenzyme (Proteasen) können an die Vorstufen binden und ein Stück am carboxyl-terminalen Ende abtrennen. Das durch diesen Schritt freigelegte Ende wird mittels einer Enzymkaskade in einer Thioesterbindung gekoppelt. Schließlich wird das Carboxyl-Ende an Substratproteine angeheftet, wobei mit dem Substrat die chemisch stabilere Peptidbindung eingegangen wird (üblicherweise mit der Aminogruppe an der Seitenkette der Aminosäure Lysin). Dieselben spezifischen Proteasen, die bei der Prozessierung der Vorstufen eine Rolle spielen, geben dem Modifikationsvorgang Reversibilität: Sie können die im Konjugat zwischen Substrat und Modifikator bestehende Bindung rückgängig machen und so das Substrat in seinen Ursprungszustand zurückführen. Abbildung 2 zeigt das Reaktionsschema der Modifikation von Substratproteinen für den Modifikator SUMO.

Da Modifikatoren kovalent an Substrate angeheftet werden, findet man sie auch als Bestandteile großer Proteine, obwohl sie selbst nur geringe Größe aufweisen. Abbildung 3 zeigt das mittels Antikörpern sichtbar gemachte Spektrum von SUMO modifizierten Proteinen der Modellpflanze Ackerschmalwand (Arabidopsis thaliana). Oberhalb der deutlich gefärbten Bande von freiem SUMO gibt es eine Vielzahl von Banden geringerer Intensität, welche SUMO- Konjugate repräsentieren. Die Identifizierung der in diesen Konjugaten enthaltenen Substratproteine ist ein wichtiger Schritt, um darauf aufbauend die Auswirkungen der Modifikation auf das Zellgeschehen zu verstehen.

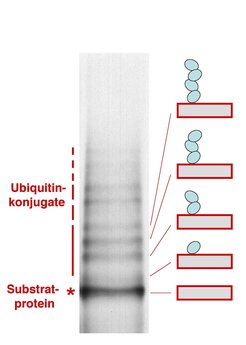
Ein weiterer Zugang zum Verständnis von Proteinmodifikatoren ist das Studium der beteiligten Enzyme. Eine Ubiquitin-Ligase aus der Ackerschmalwand kann in der Bäckerhefe (Saccharomyces cerevisiae) zur Expression gebracht werden. Zusammen mit Ubiquitin und den anderen Komponenten der Reaktionsfolge, welche in Hefezellen vorhanden sind, kann das Enzym Ubiquitin an ein Modellsubstrat anheften. Abbildung 4 zeigt die Reaktionsprodukte nach radioaktiver Markierung, Isolation und Auftrennung. Die Banden oberhalb des mit einem Stern gekennzeichneten Proteins entstehen durch einfaches, zweifaches etc. Anheften von Ubiquitin an das Substrat. Dabei ist nur der erste Ubiquitinrest direkt an das Substrat gekoppelt. Alle weiteren Reste haften an einem zuvor befestigten Ubiquitin, sodass eine Kettenstruktur entsteht. Ubiquitin ist der einzige Modifikator, für den mehrfache Bindungen an ein und dasselbe Substrat eine besondere funktionelle Bedeutung zu haben scheinen. Die Ubiquitin-Kette ist das Erkennungsmerkmal für eine komplex aufgebaute Protease, welche das modifizierte Protein in kleine Fragmente zerlegt und so aus dem Zellgeschehen entfernt. Ubiquitin-Ketten spielen bei fast allen Proteolysevorgängen der Zelle eine entscheidende Rolle. Abgesehen von der gut definierten Rolle von Ubiquitin-Ketten können in den meisten anderen Fällen die Konsequenzen der Verbindung eines Modifikators mit dem Substrat a priori nicht vorhergesagt werden. Sie müssen im Einzelnen untersucht werden.
In der Abteilung Entwicklungsbiologie der Pflanzen am Max-Planck-Institut für Züchtungsforschung sind Proteinmodifikatoren besonders im Zusammenhang mit Steuerungsprozessen von Interesse. Da die Enzymkaskade für Modifikationsreaktionen in der Zelle ständig vorliegt, eignet sich dieser Typ von Reaktionen besonders für frühe Stadien des Informationstransfers oder für die besonders rasche Verarbeitung von Signalen aus dem Zellgeschehen. In vorangegangenen Arbeiten stellte sich heraus, dass Modifikation von Proteinen durch Ubiquitin und durch SUMO in der Ackerschmalwand notwendig ist, um zum korrekten Zeitpunkt Blüten zu bilden. Welche Informationen verarbeitet eine Pflanze, wenn es darum geht, eine Blüte auszubilden? Uns allen ist geläufig, dass verschiedene Pflanzen zu verschiedenen Zeiten des Jahres zur Blüte kommen. Dabei werden als Hinweise aus der Umwelt vor allem Temperatur und Tageslänge in den entwicklungsbiologischen Ablauf eingebunden. Die Ackerschmalwand vermeidet Blütenbildung bei kurzer Tageslänge, da im natürlichen Habitat der Herbst nur zum Wachstum, nicht aber zur Blüten- und Samenbildung genutzt wird. Nach der Winterpause hingegen, oder wenn ein Same im Frühling keimt, werden bei steigender Tageslänge rasch Blüten gebildet.
Die Auswirkungen der Tageslänge auf die Blütenbildung werden vor allem durch das Protein CONSTANS (CO) vermittelt. Das CO-Protein wird bei Einbruch der Dunkelheit durch Ubiquitin-Ketten modifiziert und anschließend abgebaut. Wenn die Tage länger sind, ist auch die Verweildauer von CO in der Pflanze länger, und das Protein kann die Blütenbildung anregen. Die Modifikation wird in diesem Fall – wie in den meisten genauer untersuchten Fällen der Proteinmodifikation – von zusätzlichen Bedingungen abhängig gemacht, sie erfolgt nur unter der Zusatzbedingung der Dunkelheit. Die Frage, wie die konditionale Modifikation von CO gesteuert wird, ist Gegenstand weiterer Untersuchungen.
Auch der Modifikator SUMO hat Einfluss auf die Blühinduktion. Pflanzen mit einer defekten SUMO-spezifischen Protease können die Bindung von SUMO an eine Reihe von Substraten nicht mehr zeitgerecht rückgängig machen. Da eine solche Mutante früher zu blühen beginnt als gesunde Pflanzen, wurde sie „early in short days 4“ (esd4) genannt (Abb. 5). Umweltsignale können von der Mutante nicht mehr richtig interpretiert werden, und es kommt schon bei kurzer Tageslänge zur Blütenbildung. Da die ESD4- Protease eine Vielzahl von SUMO-Konjugaten spalten kann, ist es wahrscheinlich, dass nur ein Bruchteil der Substrate dieses Enzyms bei der Entscheidung über den Blühzeitpunkt eine Rolle spielen. Die bestehende Lücke im Wissen über die mechanistische Verbindung der SUMO-Konjugation zur Blühinduktion soll in den nächsten Jahren weiter verkleinert werden. Als erster Schritt könnte versucht werden, möglichst viele Substrate der SUMO-Modifikationsreaktion zu identifizieren, um in einem zweiten Schritt jene Substrate genauer zu untersuchen, die möglicherweise im Zusammenhang mit der Blühinduktion stehen. Bereits bekannte Komponenten der Blühinduktion könnten auch spezifisch auf ihre Beziehung zur SUMO-Modifikation untersucht werden.

Neben der Blühinduktion gibt es zahlreiche weitere Prozesse in Pflanzen, beispielsweise Zellteilung oder Seneszenz, welche ohne Proteinmodifikatoren nicht korrekt ablaufen könnten. Die Beschäftigung mit Modifikatoren verspricht also, auch in Zukunft interessant zu bleiben. Da die erwähnten Prozesse von Bedeutung für die Landwirtschaft sind, ist die spätere Anwendung neuer Erkenntnisse zur Verbesserung von Nutzpflanzen nicht unrealistisch.




