Eine neue Funktion für Glutaredoxine in der Blütenentwicklung
Forschungsbericht (importiert) 2005 - MPI für Pflanzenzüchtungsforschung
Die Blüte höherer Pflanzen stellt ein ausgezeichnetes Modellsystem dar, um Prozesse der Musterbildung zu untersuchen. Die Perzeption einer Veränderung endogener und exogener Faktoren durch die Pflanze führt dazu, dass die vegetative durch die generative Wachstumsphase abgelöst wird und dass anstatt von Blättern und Stängeln nun Blüten ausgebildet werden.
Trotz der zahlreichen Variationen in der Blütenmorphologie zwischen verschiedenen Pflanzenarten lässt sich ein gemeinsamer Bauplan in der Anordnung der Blütenorgane erkennen. Die meisten Blüten der Angiospermen sind aus vier konzentrisch angeordneten Wirteln zusammengesetzt: im ersten Wirtel werden die Sepalen (Kelchblätter) gebildet, im zweiten Wirtel die Petalen (Blütenblätter). Die Stamen (Staubblätter) entwickeln sich im dritten und die Karpelle (Fruchtblätter) im vierten Wirtel. Genetische und molekulare Analysen der homöotischen Blütenmutanten von Antirrhinum und Arabidopsis haben gezeigt, dass MADS-Box-Transkriptionsfaktoren die Identität der Blütenorgane kontrollieren. Jedoch ist noch unklar, wie in dem regulatorischen Netzwerk oberhalb der Hierarchieebene, die von den MADS-Box-Genen kontrolliert wird, die Anzahl der Blütenorganprimordien und deren Position im Blütenmeristem gesteuert wird.
ROXY1: Ein Glutaredoxin mit einer neuen Funktion in der Blütenentwicklung
Um die molekularen Mechanismen, die diesen Prozess steuern, genauer zu untersuchen, wurde in der Arabidopsis T-DNA Insertions-Kollektion von GABI-KAT eine T-DNA-Mutante mit einer anormalen Petalenentwicklung identifiziert und charakterisiert (Abb. 1). Die T-DNA -nsertion liegt in einem Gen, das für ein Glutaredoxin (GRX), eine Oxidoreduktase, kodiert. Die Analyse dieses Gens, das ROXY1 genannt wurde, zeigte erstmalig, dass ein pflanzliches GRX eine Funktion während der Blütenentwicklung ausübt.

Blüten der roxy1 Mutante bilden durchschnittlich nur 2,5 statt 4 Petalen aus, deren Entwicklung oft verlangsamt und in der Organdifferenzierungsphase anormal verläuft (Abb. 1). Die Größe der Petalen ist häufig reduziert und die Lamina sind oft gefaltet, sodass die Petalen auch nach der Anthese der Blüte nicht immer aus den Sepalen im ersten Wirtel herausragen. Expressionsanalysen mittels in situ Hybridisierungen und transgener Promotor-Reportergen-Pflanzen zeigten, dass ROXY1 mRNA und Protein nicht nur in den Petalenprimordien vorhanden sind, sondern darüber hinaus auch im jungen Blütenmeristem und in den Primordien der Sepalen, Stamen und Ovulen exprimiert werden. Da diese Strukturen keine Abweichung vom Wildtyp in der roxy1 Mutante zeigen, deutet dies auf eine eventuell redundante Funktion hin: Weitere GRXs könnten dort ausgeprägt sein und die Funktion statt ROXY1 ausüben. Durch Kreuzungen mit anderen Blütenmutanten konnte gezeigt werden, dass die ROXY1-Funktion Wirtel- und nicht Organ-spezifisch ist. Auch wenn im zweiten Wirtel in Doppelmutanten Sepalen gebildet werden, ist deren Anzahl und Organogenese defekt. Weiterhin zeigten diese Untersuchungen, dass ROXY1 auch an der Regulation der Expressionsdomäne von AGAMOUS, einem MADS-Box-Gen, das die Ausbildung der reproduktiven Organe steuert, beteilig ist. Somit übt ROXY1 eine komplexe Funktion während der Blütenentwicklung aus, die über eine Beteiligung an der Initiierung der Petalen hinausreicht.
Funktionen der GRX
GRX sind kleine (~12 kDa), ubiquitär exprimierte Redoxproteine. Sie enthalten ein typisches Dithiol- (CXXC) oder Monothiol-Motiv (CXXS), das für die Reduktion von Disulfiden verantwortlich ist. Bislang wurden überwiegend GRX aus Bakterien, Hefen, Tieren und dem Menschen analysiert, wo sie eine wichtige Rolle bei der Regulation von oxidativem Stress spielen. GRX beeinflussen mittels posttranslationaler Modifikationen die Aktivität von Proteinen. Sie können entweder intra-und intermolekulare Protein-Disulfidbrücken oder auch glutathionylierte Proteine reduzieren und damit Proteinmodifikationen wieder aufheben. Interessant ist, dass die Glutathionylierung auch für Transkriptionsfaktoren, wie beispielsweise NF-kB und c-Jun, einen Mechanismus darstellt, mit dem die DNA-Bindung in Abhängigkeit vom Redoxstatus der Zelle reguliert werden kann. Es ist nur sehr wenig über glutathionylierte Proteine aus pflanzlichen Organismen bekannt. Kürzlich wurde ein Redox-sensitiver pflanzlicher Transkriptionsfaktor, TGA1, beschrieben, der in seiner reduzierten Form eine erhöhte DNA-Bindungskapazität aufweist. Diese Beispiele zeigen, dass auch ROXY1 wahrscheinlich mittels posttranslationaler Modifikationen die Aktivität von Proteinen verändert, die eine regulatorische Funktion in der Blütenentwicklung ausüben. Ob diese entwicklungsbiologische Funktion abhängig ist von einem veränderten Redoxpotenzial der Zellen, wie es bei der Stressantwort gezeigt wurde, ist eine interessante Frage, die in Zukunft untersucht werden wird.
ROXY1 gehört zu einer pflanzenspezifischen Subklasse der GRX
Aminosäure-Sequenzvergleiche von verschiedenen GRX haben gezeigt, dass photosynthetisch aktive Organismen eine zusätzliche Gruppe von GRX besitzen. Während GRX, die ein charakteristisches CPYC- und CGFS- Motiv besitzen, in allen untersuchten prokaryotischen und eukaryotischen Spezies vorkommen, wurde eine zusätzliche Gruppe, der CC-Typ, nur in Landpflanzen identifiziert (Abb. 2).
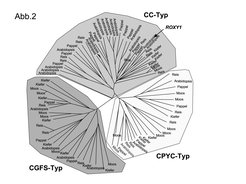
Die Aminosäure-Identität der gesamten Proteine zwischen diesen drei CPYC-, CGFS- und CC-Typ- Klassen variiert zwischen 5 und 95%. Nur vier Aminosäuren sind in Arabidopsis allen GRX-Proteinen gemeinsam: das erste Cystein des aktiven Motivs sowie ein Prolin, Glycin und Leucin im C-terminalen Teil der GRX. ROXY1 gehört zum CC-Typ, welcher mit 21 GRX, die ein CCMC- oder CCMS-Motiv besitzen, die größte Klasse in Arabidopsis darstellt. Die große Anzahl an homologen CC-Typ GRX könnte eine Erklärung dafür sein, warum der roxy1 Phänotyp, trotz einer breiten ROXY1-Expression in verschiedenen Primordien und Organen, auf die Petalen beschränkt ist. Interessanterweise ist die Gruppe der CC-TYP GRX in niederen Landpflanzen wie dem Moos noch sehr klein und besteht aus nur zwei Vertretern (Abb. 3). Bei der Kiefer, einem Vertreter der Gymnospermen (Nacktsamern), finden sich fünf CC-Typ GRX und bei den Angiospermen stellen sie beispielsweise in Arabidopsis die größte Gruppe der GRX dar. Im Vergleich dazu bleibt die Anzahl der CPYC- und CGFS-Typ GRX in den untersuchten Landpflanzen relativ ähnlich.

Was kann man aus diesen Analysen über die Funktion der GRX und ihre Evolution lernen? Zum einem zeigten sie, dass die CC-Typ GRX Funktionen ausüben könnten, die spezifisch für Landpflanzen sind. Weiterhin deutet die Expansion der CC-Typ GRX Subklasse in den Landpflanzen darauf hin, dass sich CC-Typ GRX an den im Laufe der Evolution immer komplexer werdenden Blütenstruktur-Bildungen beteiligen. Die Analyse von weiteren CC-Typ GRX wird es in Zukunft ermöglichen, auf diese Fragen eine Antwort zu finden.


